外泌体注射引发面部坏死:一例罕见并发症的警示与思考
来源:外泌体研究员 2025-12-04 15:20
只有建立在科学证据和规范管理基础上的外泌体临床转化,才能真正造福患者,推动再生医学的健康发展。
近日,《Journal of Cosmetic Dermatology》连续报道了一例罕见但严重的并发症:一名38岁男性在接受面部外泌体注射后出现缺血性坏死,导致毁容性瘢痕。这一案例为快速发展的外泌体美容市场敲响了安全警钟。

01 案例分析
外泌体应用的安全隐患何在?外泌体作为细胞间通信的关键媒介,在皮肤再生和抗衰老领域展现出巨大潜力。然而,目前没有任何外泌体产品获得注射用批准。市场上许多产品打着再生旗号,但缺乏严格的安全评估。本案例中,患者为改善痤疮瘢痕,在非医疗机构接受了冻干外泌体面部注射。三天后,双颊出现疼痛性溃疡性丘疹,符合缺血性坏死的临床表现。
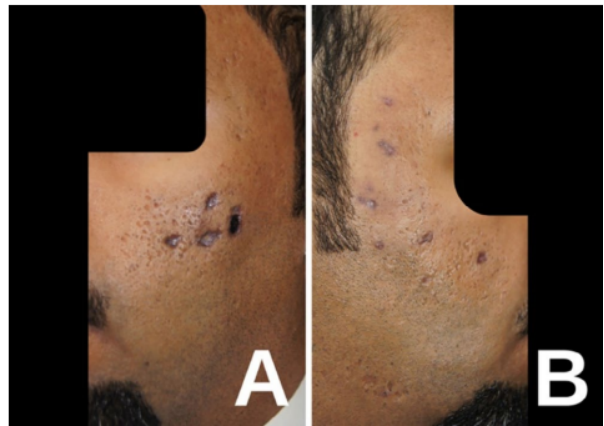
其评论文章却给出其他意见其认为缺血性坏死的诊断存在明显缺陷,首先患者拒绝活检,缺乏组织病理学确认;其次未进行血管影像学检查(如多普勒超声)以证实血管闭塞;同时,感染排查不足,未进行微生物培养。评论文章团队进一步质疑,诊断确定性存疑。坏死可能源于免疫反应、毒性损伤或压力性机制,而非单纯血管因素。他们特别指出,多次皮肤穿刺可能导致Nicolau样现象(一种罕见栓塞性并发症)。

评论文章认为治疗策略也同样值得商榷。既然诊断为血管损害,应考虑血管扩张剂、抗血小板治疗或高压氧等针对性干预。早期激光治疗对病因不明的病变作为单一疗法缺乏充分依据。
外泌体为何导致坏死?如何规避与透明质酸填充剂不同,外泌体产品无特异性拮抗剂,所以应尽量从源头避免外泌体导致的不良反应。
第一,避免外泌体聚积,因外泌体颗粒聚集物可能导致微栓塞(不管是外泌体冻干粉还是液体型外泌体,都应验证其分散稳定性和存储稳定性)。
第二,尽量提高外泌体纯度,避免条件培养基或制备工艺过程污染物引发的局部免疫反应。
第三,避免多次注射造成组织压力增高,采用微针等低压方式。
第四,注意其他安全性指标,如内毒素、支原体、无菌和病毒等指标要求阴性。
02 该案例对外泌体临床转化的启示
产品审批状态的明确性案例中使用的外泌体产品未获得任何监管机构批准用于注射,生产商明确说明该产品仅限外用。
这提示我们,在临床转化过程中必须严格区分研究用途与临床应用的界限、化妆品备案与药品批准的区别、体外使用与注射用途的适应症范围。根据《生物医学新技术临床研究和临床转化应用管理条例》第818号令,外泌体作为生物医学新技术,必须完成临床研究备案和审批程序、伦理委员会审查通过、全程质量控制体系建立和风险应急预案制定。本案中产品以化妆品名义进行注射使用,明显违背了上述规定。
技术标准体系建设迫在眉睫外泌体产品的异质性和复杂性使得质量控制尤为关键。本案中使用的人脐血条件培养基,概念模糊,缺乏明确的活性成分标准,其纯度、杂质控制、活性和稳定性等也无可查数据。外泌体的生物学效应高度依赖制备工艺,需要建立从源细胞到终产品的全流程标准,工艺相关杂质的控制标准和批次间一致性的评价体系。
安全性评价需要系统完善与透明质酸填充剂不同,外泌体目前缺乏特异性拮抗剂,这增加了风险控制的难度。未来需要开发应急处理方案,研究干预措施的有效性,并建立多学科协作的救治体系。
写在最后外泌体作为再生医学的重要组成部分,其临床转化前景广阔。然而,安全性和有效性的平衡是永恒的主题。只有建立在科学证据和规范管理基础上的外泌体临床转化,才能真正造福患者,推动再生医学的健康发展。一例坏死是一面镜子,照出产品、临床、法规、沟通四块短板。
外泌体要走向应用,必须先跨过安全这道坎。让数据说话、让标准落地、让监管长牙,才能让外泌体真正的安全递送。
参考资料:
1.Necrosis Following Dermal Injection of Lyophilized Exosomes: A Case Report2.Commentary on: Necrosis Following Dermal Injection of Lyophilized Exosomes: A Case Report
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


